根据美国疾控中心(CDC)当地时间6月21日发布的最新数据,奥密克戎新变异株BA.4/5已占据美国6月18日当周新增病例的34.9%,较前一周飙升61.57%。BA.4/5是目前为止免疫逃逸能力最强的新冠病毒变异株。更加令人担忧的是,BA.4/5还能够在人肺泡上皮细胞高效复制,而此前奥密克戎BA.1、BA.2主要在上呼吸道复制。
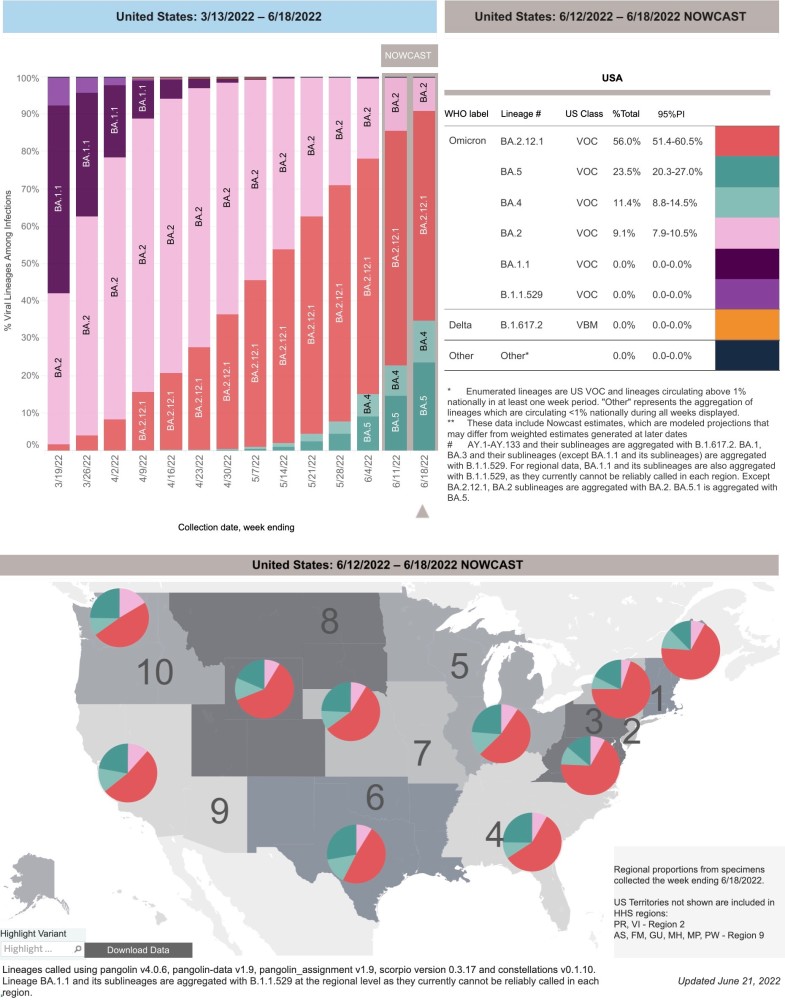
具体来说,BA.5占比约为23.5%,BA.4占比约为11.4%,大有取代BA.2.12.1之势。之前迅速取代BA.2的BA.2.12.1占比由前一周的62.7%下滑至56%。而此前被BA.2快速取代的BA.1已经接近消声灭迹。
美国去年冬天到今年春天刚刚经历了奥密克戎疫情海啸,前半程是BA.1,后半程是BA.2。然而大量人口的感染外加疫苗接种带来的人群高免疫水平还是挡不住BA.2.12.1再掀波澜。BA.2.12.1一波未平,BA.4/5又已经滚滚而来。
BA.2.12.1、BA.4、 BA.5在刺突蛋白L452位点的突变是奥密克戎BA.1、BA.2子变体所没有、而德尔塔变异株所拥有的刺突蛋白突变位点。不同的是,BA.2.12.1的突变是L452Q,BA.4/5的突变则是L452R。德尔塔也是L452R。
这意味着奥密克戎变异株在强大的正向选择压力下,在刺突蛋白基因上出现了与德尔塔毒株的趋同进化。刺突蛋白上的变异之所以尤其值得关注,因为刺突蛋白在新冠病毒进入人类细胞中起到了关键作用:刺突蛋白能结合人类细胞的ACE2受体,跨过细胞膜侵入,是打开细胞大门的“钥匙”,也是mRNA疫苗和抗体药物设计的主要靶标。
关于BA.4/5的致病性研究,此前来自东京大学、京都大学、北海道大学、九州大学、神户大学、以色列魏茨曼科学研究所等27家科研单位在医学预印本网站bioRxiv上联合发表重磅研究,显示在人类肺泡上皮细胞中的复制效率高于BA.2,特别是BA.4、BA.5比BA.2在肺泡上皮细胞中有着更强的细胞融合能力。
为了测试奥密克戎诸多变异毒株在人肺泡上皮细胞中的复制能力,研究团队通过反向遗传学准备了嵌合重组带有L452R突变的SARS-CoV-2病毒,实验显示BA.4、BA.5对人肺泡上皮细胞感染形成的斑块大于BA.2感染形成的斑块。研究者通过实验还发现,BA.4、BA.5在人类iPSC衍生的肺泡上皮细胞中复制能力比BA.2高效得多。
在BA.4、 BA.5的感染浪潮下,美国航空业因为机组人员频频中招,正在陷入紊乱,大量航班被取消。6月是美国传统的暑假出行月份,6月19日,旅客在美国各地遭遇了新一轮的航班混乱,大约1000个航班被取消。加上前一天的周五和周六,美国出入境及国内总计取消或延误了约14000个航班。
这次BA.4/5重灾区的亚特兰大哈茨菲尔德·杰克逊机场受影响尤其严重。由于达美航空取消或更改了数十个定期航班,大量乘客周末在机场中滞留。
海外巨大新冠感染基数为突变提供了源源不断的机会,于是如浪潮一般的新变异株层出不穷:免疫逃逸能力更强、传播力更强的毒株得以出现。
免疫逃逸能力更强,意味着可以重复感染。反复感染新冠的危害已引发学术界的关注。近日,美国华盛顿大学医学院、圣路易斯退伍军人健康看护系统联合发布重磅研究:Outcomes of SARS-CoV-2 Reinfection。他们通过对569万人的大样本进行研究,他们发现与首次感染新冠者相比,再感染者表现出全因死亡率、住院和诸多疾病风险的增加。而且每次感染,上述风险都会陡增。无论是未接种疫苗,还是在第二次感染前打过1针或2次或更多针的人,风险都显著增加。
而所谓的传播能力越强的变异株毒性越弱也站不住脚。国际权威学术期刊《Nature Reviews Microbiology》5月刊的一篇评论指出:奥密克戎变异株感染后患者疾病严重程度较低只是一个巧合。新冠病毒的抗原进化持续、快速,这能让层出不穷的病毒新变异株通过逃避免疫,来增强感染后的严重性。
《Nature Reviews Microbiology》是微生物领域影响因子最高的刊物,2021年影响因子为60.633。这篇评论的作者是欧盟委员会联合研究中心(JRC)的Peter V. Markov、牛津大学动物学系的Aris Katzourakis教授和欧盟委员会联合研究中心、埃尔朗根-纽伦堡大学生物计量学与流行病学系的Nikolaos I. Stilianakis。
通讯作者Markov所在的欧盟委员会联合研究中心为欧盟政策制定提供支持。Katzourakis教授更是病毒进化领域的大咖,他的研究主要集中在病毒的长期进化生物学,其在宿主基因组中发现了丰富的古代病毒序列的基因组“化石记录”,促进了这一研究的发展,从而催生了古病毒学这一新兴领域。Katzourakis教授还研究当今的病毒病原体进化和流行病学(如HIV/HTLV),以及从动物和病毒基因组序列数据进行进化推断。
他们在这篇评论文章中写道:新冠病毒(SARS-CoV-2) 由于传染力强、感染后免疫下降快、抗原进化,外加有一系列潜在的动物宿主,这使得新冠病毒能够在人类社会中持续传播。从疾病防控的角度来说,一个关键问题是预测新冠病毒的流行病学特征、临床参数以及给人类社会带来的疾病负担。
与同样被世卫组织定义为“关切变异株(VOC)”德尔塔变异株相比,奥密克戎变异株产生的症状相对较轻。作者们提到,这又点燃了人们关于病毒流行和进化的各种一厢情愿的想法:比如新的变异株是“无害”的流行;大量的疫苗接种和感染带来的普遍免疫将使疫情的浪潮变得安全;病毒有希望进行良性的进化。
他们提到,这其中流传最广也最持久的错误认知是:病毒会进化得不那么致命以保护其宿主。实际上,病毒一直承受着强大的进化压力,这会影响病毒的免疫逃逸能力和传播能力,而病毒的毒力通常只是这个过程中的一个副产品。
文章称,病毒的毒力是由宿主和病原体中各因素之间的复杂相互作用形成。病毒进化方向是最大限度地提高其传播能力,与普遍的认知不同,有时这恰恰可能与更高的毒力相关,例如,更高的病毒载量既能促进传播又能够增加疾病的严重程度。如果是这样,病毒可能会进化为更高毒力的毒株。而如果毒株的严重程度在感染后期才表现出来,也就是典型的传播窗口之后,那么毒力在病毒适应性中的作用有限,毒性强弱不会是病毒优胜劣汰中的关键。像这类在传播窗口之后才出现严重症状的病毒很多,比如新冠病毒、流感病毒、艾滋病病毒、丙型肝炎病毒等等。
也即是说,实际上预测病毒的毒力演变是一项复杂的任务,而奥密克戎变异株较低的严重性只是巧合,很难据此预测未来的变异毒株。作者们同时指出,不幸的是,未来新冠病毒更可能的进化路径是高度依赖由免疫逃逸带来再感染能力和高毒力的潜在灾难性组合。
作者们还提出一点,人们另一个普遍而朴素的信仰是:人群中广泛接种疫苗或大量感染诱导的免疫,可以保证未来感染新冠病毒新毒株时只是出现轻微症状。然而,这个想法忽略了新冠病毒生物学的一个核心特征——抗原进化,即病毒抗原谱的持续修改以响应宿主免疫压力。高速率的抗原进化可导致免疫逃逸,即新变异毒株降低免疫系统响应能力,进而导致再感染和随之而来的潜在严重疾病。在人群水平上,抗原进化和逃逸会通过增加再感染率和重症率来增加医疗资源负担。
奥密克戎毒株清楚地表明,新冠病毒能够在相对较短的时间内产生大量突变实现抗原逃逸。与原始毒株相比,奥密克戎毒株至少具有50个氨基酸突变,并且与早期的阿尔法、贝塔、伽马、德尔塔等流行株具有高度的抗原性差异。奥密克戎在高免疫人群中引起的传播海啸表明,这些突变使该变体能够轻松感染因先前感染或接种疫苗而具有免疫力的个体。奥密克戎下的各个亚谱系之间的遗传差异也相当大,并且这种差异的功能重要性正在通过奥密克戎BA.2毒株的大量传播得到体现。
作者们回顾道,2020年9月,在经历了最初的相对进化稳定期之后,与新冠病毒原始毒株具有相当大抗原差异变体开始出现。至少三种较早的VOC——贝塔、伽马、德尔塔,具有很强的免疫逃逸突变特征。目前没有任何迹象表明新冠病毒的抗原进化在未来会放缓。相反,这些“关切变异变异株(VOC)”只是“进化冰山”的一角。随着时间的推移,数百个新冠病毒亚谱系不断相互分化,根据进化理论预测,新冠病毒未来免疫逃逸变异的机会将大大增加。
病毒的适应性程度可以通过其有效再生数 (Rt) 体现。 Rt 是感染病例在人群中产生的继发感染总数。因此,适应性最强的变异株是传播给最多宿主的变异株。在每个人都易感的人群中,病毒可以通过变得更具传染性来实现这一目标。早期的“关切变异株(VOC)”就是这样演化而来的:阿尔法和德尔塔的传染性都比前一个主导毒株高出大约50%。在大量感染人口被占据流行主导的过程中,每一个VOC都迅速取代另一个VOC。
他们同时指出,然而,在高度免疫的人群中,仅仅增加内在传染力对扩大传播带来的贡献相对较小,因为这种情况下,障碍传播的主要因素是宿主对感染的免疫能力。因此,随着人类向高水平免疫过渡,预计新冠病毒将通过提升其重新感染免疫个体的能力来日益优化其传播性 (Rt),而不是通过高度传染性来优化其传播性 (Rt)。因此,免疫水平的提高可能会加速病毒的抗原进化速度,从而增加再感染的风险,并可能增加再感染的疾病严重程度。实际上,奥密克戎的快速传播得益于其重新感染免疫个体的非凡能力,正体现了这种进化策略。